化学学院刘文博课题组:简单高效的芳香恶唑啉化反应
亲电芳香取代反应(SEAr)是有机化学中的重要转化,例如常见的亲电芳香溴化、硝化以及傅克烷基化和酰基化反应。发展一种强大且实用的亲电芳香取代反应以实现芳香C-H键的多样官能团化受到了人们广泛的关注。恶唑啉在有机合成中具有很高的合成价值: 1)它可以作为有力且可移除的导向基团,用于过渡金属催化的C-H活化和邻位导向金属化反应;2)它存在于很多配体中,例如众所周知的PHOX型配体;3)它在简单温和的条件下能转化为羧酸、醛和腈。目前主要是通过羧酸、醛以及腈与不同的1,2-氨基醇之间的缩合来制备恶唑啉。尽管这些方法用途广泛,但是往往需要底物上具有预官能团,因此发展一种直接通过C-H键的官能团化一步构建恶唑啉的方法具有十分重要的意义。近日,中山大学化学学院刘文博课题组报道了一种芳香C-H键恶唑啉化的方法(图1),相关研究成果发表在Precision Chemistry上。
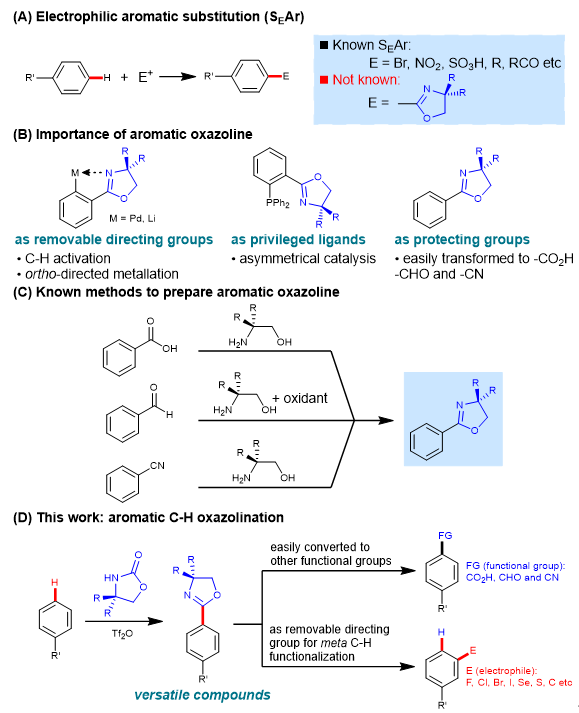
图1. 芳香C-H恶唑啉化的意义
首先作者用苯乙醚1a和2-唑烷酮2f作为模板底物,对活化试剂的种类和当量,反应的溶剂,温度和恶唑烷酮的种类进行了筛选(图2)。实验结果表明,以3当量的三氟甲磺酸酐作为添加剂,DCE为溶剂,在70 ℃下反应,可使目标产物产率达到最佳。
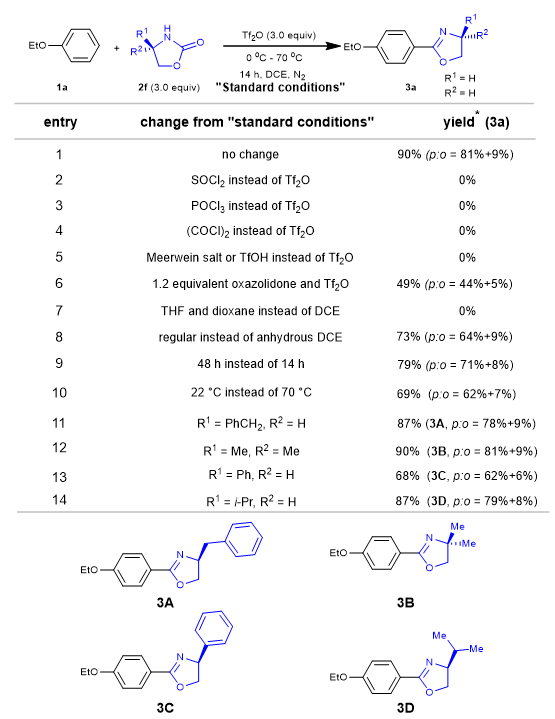
图2. 反应条件筛选
随后,在最优反应条件下作者对底物的普适性进行了考察(图3)。实验结果表明各种芳烃和杂芳烃都能以中等到良好收率得到目标产物。
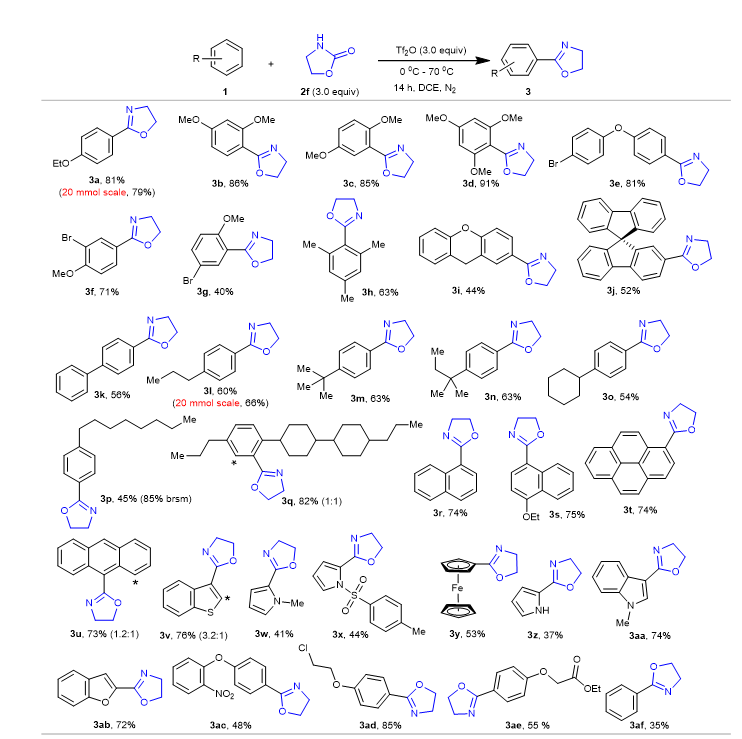
图3. 亲电芳香恶唑啉化芳烃范围
作者还对萘普生、吉非罗齐、恶唑菌酮、吡丙醚、三氯生、维生素E、达泊西汀、酚苄明、噻氯匹啶、西力士、阿戈美拉汀、辣椒素和环丙贝特等多种药物衍生物进行了尝试(图4),发现它们都能得到所需的恶唑啉化产物,这表明该反应在复杂分子后期官能团化方面具有很大的潜力。
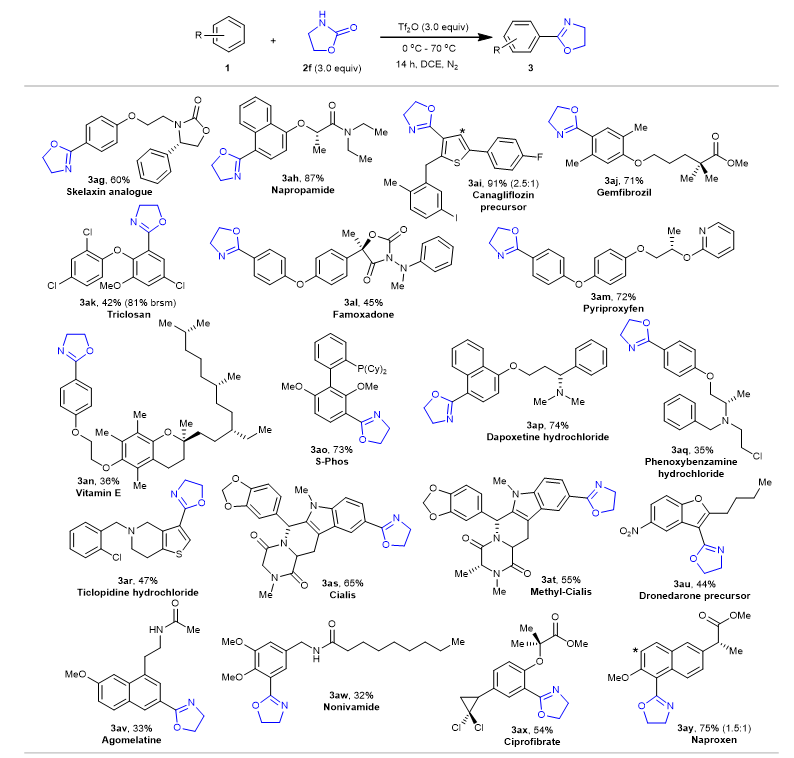
图4. 复杂芳香分子的亲电芳香恶唑啉化
为了说明该方法的合成价值,作者制备了很多其它方法很难制备的官能团化芳烃。主要包括(a)将恶唑啉直接转化成羧酸,醛,腈和恶唑;(b)直接从芳烃制备PHOX-型配体;(c)恶唑啉导向的邻位碳氢键活化反应;(d)乙氧基苯的间位硒化,氯化,溴化,氘化,甲基化,氟化和硫化等官能团化反应; (e)正庚苯的间位硒化,氯化,溴化,氘化,甲基化,氟化和硫化等官能团化反应;(f)正庚苯的苄基位甲基化,氘化和二聚。这些例子清晰地表明,该亲电芳香恶唑啉化可以用于合成其它方法不能制备的多样性芳香化合物。
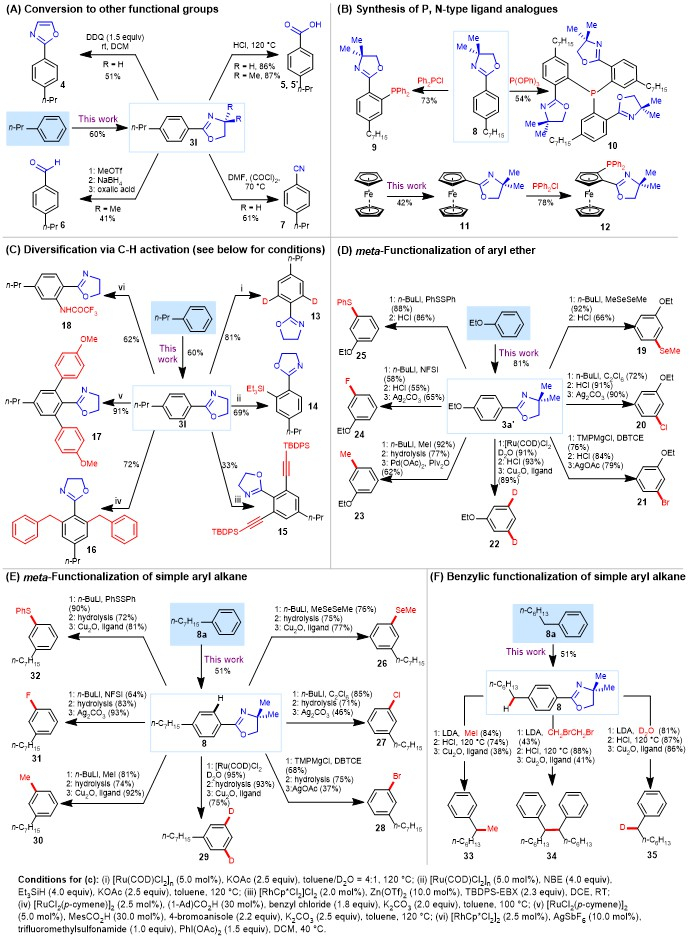
图5. 亲电芳香恶唑啉化作为关键步骤的多样导向性合成
除了在芳香族化合物的多样化方面的应用外,作者还利用该芳香恶唑啉化反应作为关键步骤从简单的芳烃作为起始原料合成了氟比洛芬,γ-分泌酶抑制剂,氟卡尼和非布索坦四个药物分子(图6)。
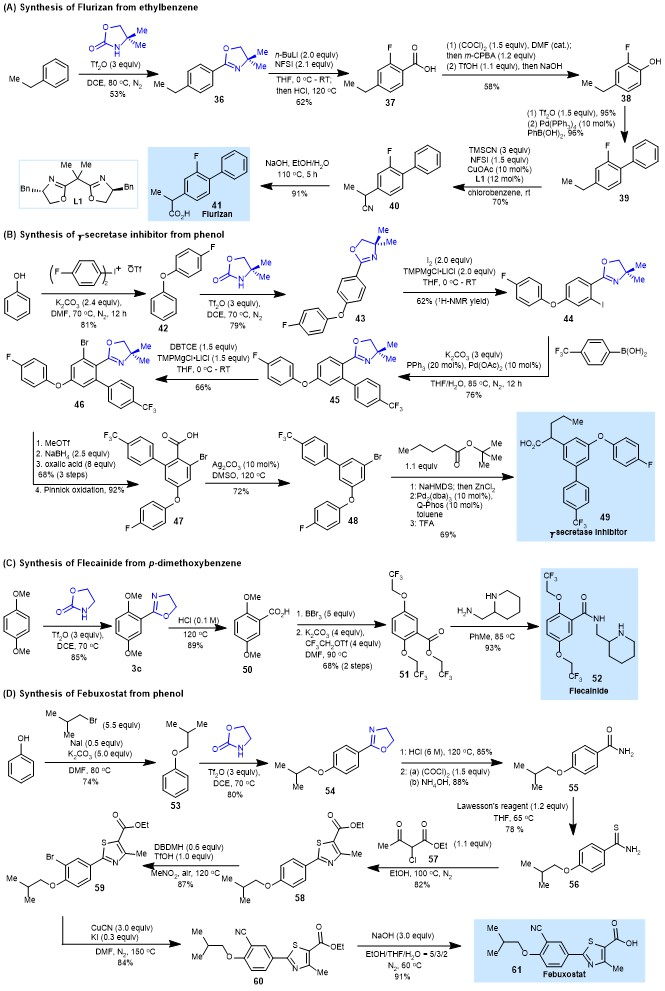
图6. 亲电芳香恶唑啉化作为关键步骤的目标导向性合成
最后作者还对反应机理进行了研究并且提出了反应可能的机理(图7),2-唑烷酮在三氟甲磺酸酐的活化下形成亚胺中间体并被富电子芳烃亲核加成形成中间体65,通过KIE效应证明该过程芳香碳杂化方式经历了sp2到sp3的转变,65芳构化形成热力学不稳定的四面体中间体66并转化成最终的恶唑啉产物。
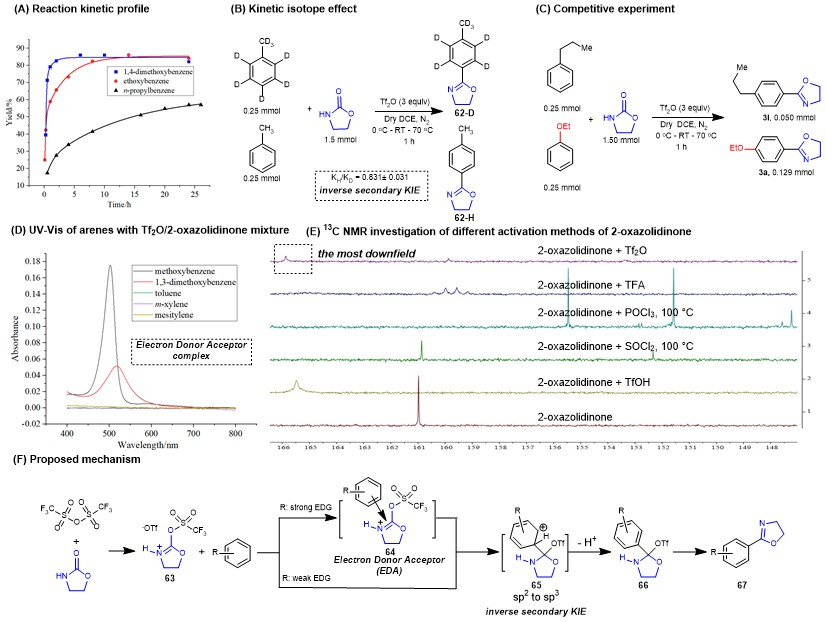
图7. 机理研究
总结
综上所述,刘文博教授团队开发了一种亲电芳香C-H恶唑啉化反应,可以在简单的条件下一步将芳烃转化为芳香恶唑啉化合物。该反应易于放大,底物普适性广,官能团兼容性好。通过使用这种芳香恶唑啉化反应作为关键步骤,可以实现芳烃多样官能团化,也可以从简单原料合成四种重要的药物。该工作得到了中山大学启动基金、高校基本科研业务费、广州市科技局基本科研业务费和国家自然科学基金项目的大力支持。相关工作发表在Precision Chemistry上。中山大学化学学院刘文博教授为通讯作者,中山大学化学学院为通讯单位,2022级博士生史秋为论文第一作者。
相关论文链接:https://pubs.acs.org/doi/10.1021/prechem.3c00035

